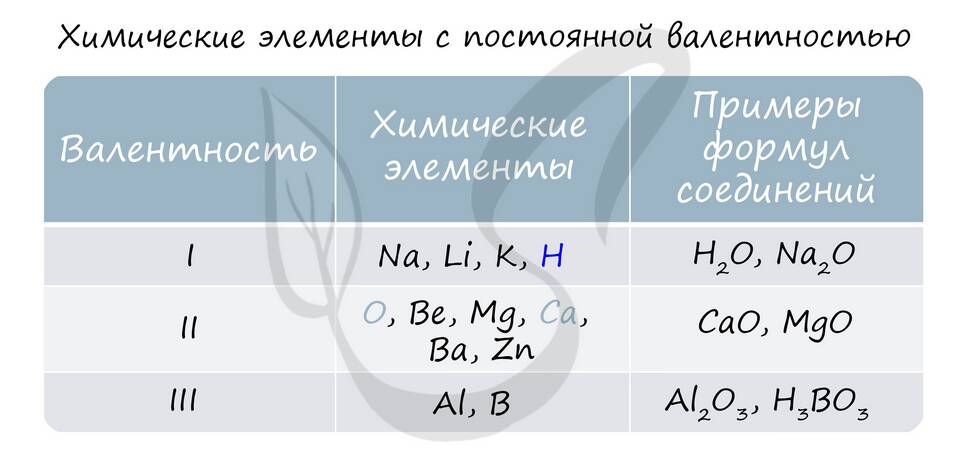
Сумма степеней окисления - это важное понятие в химии, которое помогает определять состав соединений и балансировать химические уравнения. Рассмотрим основные правила определения этой величины.
Содержание
Основные правила
- В нейтральном веществе сумма степеней окисления всегда равна нулю
- В ионе сумма степеней окисления равна заряду иона
- Степень окисления простых веществ всегда равна нулю
- Кислород в соединениях обычно имеет степень окисления -2 (кроме пероксидов)
- Водород в соединениях обычно имеет степень окисления +1 (кроме гидридов)
Примеры расчетов
| Соединение/ион | Расчет суммы | Результат |
| H2O | 2(+1) + 1(-2) | 0 |
| CO2 | 1(+4) + 2(-2) | 0 |
| SO42- | 1(+6) + 4(-2) | -2 |
| KMnO4 | 1(+1) + 1(+7) + 4(-2) | 0 |
Специальные случаи
Пероксиды (например, H2O2)
Кислород имеет степень окисления -1. Сумма: 2(+1) + 2(-1) = 0
Гидриды (например, NaH)
Водород имеет степень окисления -1. Сумма: 1(+1) + 1(-1) = 0
Озон (O3)
Как простое вещество имеет сумму степеней окисления 0
Алгоритм определения
- Определить известные степени окисления элементов
- Установить общий заряд молекулы или иона
- Составить уравнение для неизвестной степени окисления
- Решить уравнение относительно неизвестной
- Проверить полученные значения
Практическое применение
| Область применения | Значение |
| Балансировка уравнений | Помогает в методах электронного баланса |
| Определение окислителей и восстановителей | Показывает изменение степеней окисления |
| Прогнозирование свойств веществ | Позволяет предсказать химическое поведение |
Частые ошибки
- Забывают, что сумма для иона равна его заряду
- Не учитывают особые случаи для кислорода и водорода
- Путают степень окисления с валентностью
- Не проверяют полученные значения на реалистичность
Понимание принципов расчета суммы степеней окисления является фундаментальным для изучения химии и необходимо для успешного решения химических задач и проведения расчетов.